Bochum, 22. Januar 2019:
Am 8. Januar wurde in Japan als erstem Land Romosozumab für die Osteoporosetherapie zugelassen. Im DGE-Blog wurde erstmals im Jahre 2012 (1) und in den folgenden Jahren mehrfach über diese Substanz der Firmen AMGEN und UCB berichtet. Es handelt sich um einen gegen Sklerostin gerichteten humanisierten monoklonalen Antikörper. Sklerostin ist ein von den Knochenzellen sezerniertes Protein, welches die Knochenneubildung hemmt, sein dagegen gerichteter Antikörper Romosozumab wirkt somit osteoanabol. Dies erkennt man am Anstieg des Prokollagen-1-N-terminalen Peptids (P1NP), eines Markers des Knochenanbaus. In der FRAME-Studie (2) bei postmenopausalen Frauen bewirkte im 1. Jahr die 1x monatliche s.c. Gabe von Romosozumab gegenüber Plazebo einen Rückgang der Wirbelkörperfrakturen. Nach dem ersten Jahr wurde das Antiresorptivum Denusomab (Prolia®) gegeben und nach zwei Jahren waren die Wirbelkörperfrakturen um 75% vermindert. Als ernste Nebenwirkungen war es unter Verum zu zwei Kiefernekrosen und einem atypischen Oberschenkelbruch gekommen. In einer Head-to Head-Studie von Romosozumab vs. Alendronat (ARCH-Studie) zeigte sich, ebenfalls an postmenopausalen Frauen, auch ein günstiger Knocheneffekt. Hier kam es in der Romosozumab-Gruppe jedoch häufiger zu ernsten kardialen und zerebrovaskulären (CV) Ereignissen (3) . Diese waren auch in der BRIDGE-Studie an männlichen Osteoporosepatienten häufiger. Da sich Sklerostin außer im Knochen auch im Aortengewebe und hochreguliert bei Gefäßverkalkungen und in Herzklappen findet, könnte Sklerostin ein negativer Regulator für Gefäßverkalkungen sein. Ob dies die potentiellen ernsten CV Nebenwirkungen von Romosozumab erklären könnte, ist offen. Die CV Sicherheitsdaten lagen der FDA beim ersten Zulassungsantrag im Mai 2017 nicht vor, er wurde daher zurückgestellt (4).
Zulassungsstatus:
Japan (PMDA): Am 8. Januar 2019 wurde Romosozumab mir dem Handelsnamen Evenity in Japan approbiert.
FDA: Vor wenigen Tagen votierte das FDA-Beratergremium mit 18:1 Stimmen (mit gewissen Vorbehalten einiger Mitglieder) für die Zulassung dieses knochenanabolen Osteoporosemedikaments, mit der von AMGEN vorgeschlagenen Indikationsstellung: Osteoporosebehandlung postmenopausaler Frauen mit hohem Frakturrisiko, definiert als: Vorgeschichte mit osteoporotischen Knochenbrüchen, multiple Risikofaktoren für Brüche, oder ungenügende Wirkung oder Unverträglichkeit anderer Osteoporose-Medikamente. Eine Box im Beipackzettel soll eine Warnung für Patienten enthalten, die schon einmal Herzattacken oder einen Schlaganfall hatten. Im zweiten Zulassungsantrag an die FDA vom 16.1.2019 steht: „A meta-analysis of time to first MACE using data from all three phase 3 trials, found a HR of 1.40 (95% CI: 0.99-1.99) for the comparison of rosomozumab to placebo and alendronate combined”. Es wurde ein möglicher CV Schutzeffekt von Alendronat diskutiert (Daten der ARCH-Studie im 1. Jahr auf der Abbildung unten).
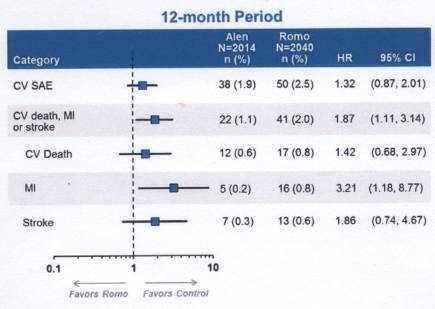
Abbildung aus dem Antrag an die FDA vom 16.1.2019: CV Daten der ersten 12 Monate der ARCH-Studie (Alendronat vs. Romosozumab)
EMA: Am 7. Februar 2019 soll über Romosozumab eine Sitzung bei der Europäischen Behörde EMA stattfinden.
Kommentar
Bei den Osteoporosemedikamenten gab und gibt es ein ständiges Auf und Ab: Als Basistherapie werden nach wie vor Kalzium und Vitamin D gegeben, aber auch darüber wird in letzter Zeit diskutiert. Als spezielle Medikamente wurden anfangs die heute weitestgehend verschwundenen Fluoride (Ossin u.a.) eingesetzt, welche zwar mehr, aber minderwertigen Knochen bildeten und zu einer erhöhten Frakturrate führten. Im Unterschied zu früher wird auch Calcitonin heute kaum mehr verwendet. Calcitonin-Nasensprays zur Osteoporose-Behandlung wurden aufgrund eines erhöhtes Malignitätsrisikos vom Markt genommen. Bisphosphonate hingegen werden zur Zeit als Mittel der ersten Wahl angesehen. Sie wurden bei der Waschmittelproduktion von Procter und Gamble entdeckt und von dieser Firma als Medikament (Diphos) insbesondere für den Morbus Paget vertrieben. Dann kamen viele Osteoporose-Therapeutika aus dieser Gruppe (Alendron-, Etidron-, Ibandron-, Risedron-, Zoledron-Säure u.a.) auf den Markt (Clodronat und Pamidronat sind zur Osteoporosebehandlung nicht zugelassen). Bei Frauen werden selektive Östrogenrezeptor-Modulatoren wie Raloxifen (Evista u.a.) eingesetzt. Mit Denusomab (Prolia), einem humanen monoklonalen anti-RANKL-Antikörper, der wie Osteoprotegerin wirkt, häufen sich in letzter Zeit Berichte über rasch nach Absetzen auftretende multiple Wirbelkörperbrüche. Erstmals in Europa wurde von den Schweizer Arzneibehörde davor gewarnt (5).
Als Osteoanabolica sind Parathormonanaloga (Teriparatid (Forsteo)) verfügbar. Ein Analogon des PTH-related Proteins (Abaloparatid) ist in den USA zugelassen, wurde von der EMA 2018 aber nicht approbiert. Strontiumranelat (Protelos u.a.), welches wie Kalzium in den Knochen eingebaut wird, wies schwere unerwünschte Nebenwirkungen auf. Es ist mit 31. August 2017 vom Markt genommen worden und bei uns nicht mehr erhältlich. Odanacatib der Firma Merck & Co., ein Cathepsin-Inhibitor, war schon weit fortgeschritten. Im Herbst 2016 wurde seine Weiterentwicklung trotz guter Frakturverhinderung eingestellt, da ein erhöhtes CV Risiko, insbesondere für Schlaganfälle bestand (6). Ähnlich kritisch wurden wegen der gesteigerten CV Nebenwirkungen die Chancen für Romosozumab für eine Zulassung von Analysten eingestuft. Der Antrag wurde auch am 22. Mai 2017 von der FDA zurückgestellt (4). Nach jetzt erfolgter Approbation von Romosozumab in Japan (s.o.) wird man sehen, wie die Arzneibehörden in den USA und in der Europäischen Union entscheiden werden. Romosozumab ist ein osteoanaboles Medikament, welches in Sequenz mit einem Antiresorptivum wie etwa einem Bisphosphonat gewiss vorteilhaft wäre. Ob man es aber mit Denusomab (Prolia) wie in der FRAME-Studie kombinieren soll, sei dahingestellt. Beim Absetzen von Denusomab traten nämlich multiple Wirbelbrüche auf, wie auch im DGE-Blog berichtet wurde. Insofern wäre eine Kombination mit Bisphosphonaten eher sinnvoll.
Diese ausführliche Schilderung des Auf und Ab der Osteoporosepräparate soll zeigen, wie schwierig es für eine Substanz ist, 1.) zugelassen zu werden und 2.) sich dann in der „real world“ auf dem Markt zu halten.
Helmut Schatz
Literatur
(1) H. Schatz: Zwei neue Medikamente für die Postmenopausale Osteoporose: Romosozumab und Odanacatib.
DGE-Blog-Beitrag vom 5. November 2012
(2) Helmut Schatz: Romosozumab, ein Sklerostin-Antikörper erhöht rasch die Knochendichte und senkte in der FRAME-Studie in Sequenztherapie mit Denusomab (Prolia®) bei postmenopausalen Frauen ausgeprägt die Wirbelbrüche.
DGE-Blogbeitrag vom 2. Oktober 2016
(3) Kenneth G. Saag et al.: Romosozumab or alendronate for fracture prevention in women with osteoporosis.
New Engl. J. Med. online September 11, 2017. DOI: 10.1056/NEJMoa1708322
(4) Helmut Schatz: Sklerostin-Antikörper Romosozumab zur Osteoporosebehandlung von FDA nicht zugelassen.
DGE-Blogbeitrag vom 20. Juli 2017
(5) Helmut Schatz: Prolia® (Denusomab): Rebound-Effekt mit multiplen Wirbelbrüchen nach Absetzen der Therapie.
DGE-Blogbeitrag vom 12. Februar 2017
(6) Helmut Schatz: Neue Osteoporosemedikamente: Weiterentwicklung von Odanacatib wegen erhöhten Schlaganfallrisikos eingestellt, Romosozumab ebenfalls mit erhöhtem kardiovaskulären Risiko?
DGE-Blogbeitrag vom 6. September 2017
Bitte kommentieren Sir diesen Beitrag!
Danke für diese tolle Zusammenfassung! Insbesondere der Konklusion kann ich mich voll anschließen. Ja, Osteoporose ist eine häufige Erkrankung mit einer langen Therapiedauer – hier ist die Berücksichtigung auch sehr seltener Nebenwirkungen wirklich relevant. Die tägliche Praxis zeigt jedoch wie das Pendel auch auf die Gegenseite ausschlägt: Bisphopshonate werden aus Angst vor Kieferknochennekrosen und atypischen Femurfrakturen, Denosumab aus Angst vor einem möglichen Reboundeffekt mit sehr seltenen multiplen Wirbelkörperfrakturen, Östrogene aus Angst vor Brustkrebs und Raloxifen aus Angst vor Thrombosen nicht eingesetzt, so dass die therapeutische Lücke (Treatment gap) in Deutschland riesig ist. Wir sollten uns immer wieder klar machen, dass bei einer klug indizierten Osteoporosetherapie die Wahrscheinlichkeit einer – nicht selten zur dauerhaften Pflegebedürftigkeit (oder Tod) führenden – Major-Fraktur um das 1000-fache höher ist als das Auftreten einer Nebenwirkung. Auch eine Nicht-Therapie kann sehr gefährlich für unsere Patienten sein! Das Wissen über die seltenen Nebenwirkungen sollte uns zu einer klugen Auswahl des individuell besten Medikaments führen und nicht zum verängstigten Nichtstun verleiten. Viele Grüße, Ralf Schmidmaier
Tolle Übersicht von Helmut Schatz und auch volle Zustimmung für Ralf Schmidmaier, nachdem ich gerade auf der OSTELOGIE 2019 in Frankfurt a.M. zusammen mit Björn Bühring die Seeion “ Nebenwirkunen bei der Osteoporosetherapie“ moderiert habe.
Viele Grüße, Christian Günther
Natürlich OSTEOLOGIE 2019, “ Session“ und Christian Günther
Guten Abend,
meine Osteoporose wurde in 2012 diagnostiziert. Knochendichtemessung auf eigenen Wunsch, sozusagen „Zufallsbefund“. T-Score Hüfte -3,0, LWS deutlich schlechter. Heute, ohne spezielle Osteoporosemedikamente Hüfte T-Score -2,6 , LWS weiterhin schlecht, aber dem Grundsatz nach stabil. Bisher ohne Brüche, derzeit keine Beschwerden.
Ich habe mich gegen eine spezielle Osteoporose-Therapie entschieden. Direkt nach der ersten Messung wurden mir Medikamente empfohlen. Es muss gut überlegt sein, in jedem Einzelfall, ob man Medikamente nimmt, die derart in den Knochenstoffwechsel eingreifen. Niemand hat sich nach meiner Ernährung erkundigt, niemand hat gefragt, was ich für Sport mache. Niemand hat mir Alternativen aufgezeigt. Ich wurde nicht umfassend untersucht, um evtl. herauszufinden, woher die Osteoporose kommt. Viel zu schnell wird meines Erachtens eine Osteoporose-Therapie eingeleitet.
Ich habe noch ein – vermutlich – nicht ossifzierendes Fibrom im Verlauf der Corticalis am mittleren Humerusschaft sowie am Humeruskopf ein (vermutlich) Enchondrom, welches seit Jahren so gut wie unverändert ist und bisher keine Probleme macht. Ein Grund mehr für mich, erstmal nichts einzunehmen.
Erst wenn ich meinen ersten Knochenbruch habe, werde ich mir wieder ernsthaft Gedanken um eine spezielle Osteoporosetherapie machen. Solange werde ich weiter meine Ernährung optimieren, mich antientzündlich ernähren, in das Krafttraining gehen, auf meinem Minitrampolin springen, Seilspringen und meine Bauch- und Rückenmuskulatur weiter stärken. Nicht zu vergessen Vitamin D, K2 , Calcium, Optimierung SD-Hormone etc.
Ich habe jetzt schon öfter gehört von Menschen, die eine stark verringerte Knochendichte, aber keine Brüche und keine Beschwerden haben und bei denen die Dichte über Jahre stabil ist. Vielleicht ist das bei einigen auch ein Stück weit normal und die Knochenstruktur ist gut, diese wird ja häufig nicht erfasst. Ich meine, jeder einzelne Patient muss sehr genau angeschaut werden und benötigt eine wirklich individuelle Beratung.
Grüße
Sehr geehrte Frau P., sehen Sie doch Ihren DVO- Score (ln der Tabelle des Dachverbandes Osteologie) nach. Dort finden Sie, in Abhängigkeit von Ihrem Alter, Z-Score usw., ob eine spezielle Osheoporosetherapie angezeigt ist oder alleinige Allgemeinmaßnahmen empfohlen werden.
Pardon, es muss natürlich T-Score und nicht Z-Score heissen. Vertippt!
Sehr geehrter Herr Professor Schatz,
vielen Dank, diese Tabelle ist mir bekannt. Wenn sich an meiner LWS durch meine ganzen Bemühungen etwas zum Postiven entwickelt, dann habe ich es auch ohne spezielle Osteoporose-Therapie geschafft. Ich arbeite daran.
Bei Gelegenheit werde ich in das Osteoporosezentrum nach München oder Hamburg fahren, um eine Zweitmeinung einzuholen.
Grüße
Liebe Fr P
Osteoporose ist eine unterschätzte Erkrankung -Es gibt3(4) Medikamente – 10% der Bevölkerung sind betroffen – bei Fractur (Major fract) über 75 sterben im 1 Jahr 20 % 60 % bleiben behindert – 20 % resititutio ad Intergrum – kostet in Österreich 1-2 Millarden /Jahr
Für die Diagnose brauch man Labor Anamnese (Osteocheckbogen)- fakultativ DEXA – wenn möglich mit TBS
Basistherapie = Osteoporoseturnen – Ca/Vitamin D – ev +K2 – dann erst bei Indikation spez Th
bei Frauen perimenopausal + Raloxifen – bei eingeschränkter Niere geht nur Denusomab = Rankl Ligand AK – sonst Bisphosphonate – bei CIOP = Cortisoninduzierter Osteoporose – primär Teriparatid mögl. – ansonsten bei Fract unter antiresorptiver TH. – sonst aktuell keine weitere Therapieoption – Odanacatip nicht zugelassen – NW : Insult – Protelos NW: CV Ereignisse vermehrt
Antiklerostin seit 8 1 in Japan zugelassen = Romosozumab
Sehr geehrter Herr/Frau Vasole,
vielen lieben Dank für die Mühe. Interessant wäre zu erfahren, warum so viele Menschen sterben nach einem Bruch über 75 J. Sind es Folgeerkrankungen wie Lungenentzündung, Thrombosen etc. durch Bettlägerigkeit… ?
Wenn diese Erkrankung so unterschätzt wird und Milliarden kostet, warum wird nicht mehr für die Prävention getan, warum nicht bei jedem ab 40 J. einmal die Knochendichte erfassen, damit man Vergleichswerte hat für später? Warum nicht umfassende Aufklärung über Risikofaktoren?
Ich bin sehr enttäuscht über die Aufklärung und Vorschläge, die ich erhalten habe. Um eine relativ umfassende Untersuchung (abseits einem Besuch beim Endokrinologen) Labor etc. musste ich mich selbst kümmern. Bei meinem NUK erhalte ich immer einen Fragebogen, dort steht z.B.: „Machen Sie Sport, falls ja, wie häufig?“ Es interessiert einfach nicht, ob ich Bungee Jumping mache, mit dem Rad fahre, oder vernünftigen Osteoporosesport. Es wird auch im anschließenden Gespräch nicht thematisiert. Nach Ernährung etc. bin ich noch nie gefragt worden. Ich denke, da ist viel Verbesserungspotential. Ich gehe immer sehr frustriert aus der Praxis mit Hochrechnungen über mein Bruchrisiko in den kommenden 10 Jahren und orientiere mich nun um. Ich wünschte, hier wäre noch ein zweiter NUK, mit welchem ich einen wirklichen Austausch erlebe, aber weit und breit niemand da.
Ich bin 54 J., Menopause Ende 30. Ich wollte Anfang April zu einem von mir sehr geschätzten Endokrinologen (wegen SD und Osteoporose), musste aber den Termin verschieben, so dass ich bis Juli warten muss. Hier ist leider weit und breit keine Praxis mit einem Gerät, welches die Knochenstruktur erfasst. Dafür müsste ich tatsächlich nach München oder Hamburg, als Selbstzahlerin, ca. 400 Euro wird es kosten.
DXA-Messung überzeugt mich nicht so wirklich, denn es wird ja nicht tatsächlich die Dichte gemessen, es ist eine zweidimensionale Messung. Mein schlechtester LW hat
T-Score – 5,0, ich müsste eigentlich Medikamente nehmen, aber bisher bin ich im 8. Jahr ohne Medikamente und hoffe, dass es so bleibt und vielleicht besser wird durch meine ganzen Bemühungen.
Nochmals danke für Ihre Mühe und die Infos.
Herzliche Grüße
Sehr geehrte Damen und Herren,
da ich hier schon geschrieben habe, möchte ich auch hier gerne eine Frage stellen:
Vorab: Im Juli habe ich einen Termin beim Endokrinologen, ich benötige oder erbitte nur eine Einschätzung hinsichtlich einer Frage weiter unten.
Ich habe 30 Jahre sehr viel Streß gehabt – Negativstreß, permanente „Alarmbereitschaft“, Aufregungen etc. , ein paar wenige Jahre war es etwas ruhiger, derzeit ist wieder sehr viel Streß. Ich habe nach Aufregung schlimme Müdigkeitseinbrüche, mehrmals tags drauf etc. Mit Blick auf meine Osteoporose und Müdigkeits“anfälle“ habe ich beim Hausarzt u.a. Cortisol und ACTH bestimmen lassen (weil mein Termin beim Facharzt noch so lange hin ist).
Meine Ergebnisse (morgens um 7.30 Uhr):
Cortisol: 261 ng/ml (morgens 50-200)
ACTH: 50.4 pg/ml (7.2-63.3)
weiter:
AP: 67 U/l (35-105)
Knochen-AP: 14.8 µg/l (5-25)
Unter 81,25 LT und 5 T3
TSH: 0,24
FT4: 13,48 (8,9 – 18,60 pg/ml)
FT3: 2,84 (2,10 – 4,70 pg/ml) (T3-Karenz 8 Stunden)
(keine SD mehr vorhanden, nur ein vernarbter Rest nach abgelaufener Hashimoto-Thyreoiditis).
Nun habe ich reduziert auf 75 LT und 5 T3 (mittags 2,5 T3 und um 22.30 Uhr 2,5 T3).
Meine Frage an Sie: Erstmal positiv denkend davon ausgehend, dass ich keine Tumore oder Ähnliches habe und evtl. alles dem Streß geschuldet ist (evtl. auch meine Osteoporose zu großen Teilen):
Hat die Einnahme von T3 einen Einfluß auf die Nebennniere? Wenn ja, inwiefern, positiv oder bei Streß eher negativ? Mein letzter Versuch ohne T3 hat mir nicht gut getan. 7,5 T3 bekamen mir immer sehr gut.
Vielen Dank.
Stress – positiv oder negativ – wohl ohne Einfluß auf Osteoporose, wenn man auch pathophysiologisch an eine Wirkung von streßbedingten Cortisolspitzen auf den Knochen denken mag. Ich glaube es aber nicht. T3 hat m.W. keinen Einfluß auf die Nebenniere. Diese scheint aber bei Ihnenohnedies in Ordnung zu sein, das grenzwertig hohe Cortisol morgens bei normalem ACTH ist eher bedeutungslos. Wenn Ihr Endokrinologe, mit dem Sie das besprechen sollten , genau testen möchte -das muß aber er entscheiden – kann man noch einen Suppressionstest vornehmen und/oder das Urincortisol messen, am besten im exakt gesammelten 24h-Urin. Zunächst aber ist ein Cortisol-Tagesprofil angezeigt. Wenn eine Tagesrhythmik vorhanden ist, d.h. die Werte nachmittags bis zum Abend heruntergehen, ist die Nebenniere in Ordnung.
Recht herzlichen Dank, Sie haben mir sehr geholfen.
Beste Grüße
Anfang April 2019 ist von der FDA Romosozumab (Handelsname Evenity) zugelassen worden zur „Osteoporose-Therapie postmenopausaler Frauen mit Fraktur-Vorgeschichte oder multiplen Bruch-Risikofaktoren oder Erfolglosigkeit oder Unverträglichkeit anderer Osteoporosetherapien“. Es soll nicht öfters als 12 mal in monatlichen Abständen gegeben werden, da dann der knochenanabole Effekt schwindet. Dann habe eine antiresorptive Behandlung zu folgen. Wegen der CV Risiken sollen die Patientinnen sorgfältig ausgewählt werden und Romosozumab bei Herzproblemen nicht eingesetzt werden.Man war bei der FDA der Ansicht, dass die Vorteile von Romosozumab aber deren potenzielle CV Risiken aufwiegen würden.
Im Juni 2019 wurde Romosozumab (Evenity) im Unterschied zu Japan und der FDA von der EMA wegen gehäufter Herzinfarkte und Schlaganfälle nicht zugelassen.
Dankeschön. Ich stimme Ihnen zu 100 Prozent zu.
Ich bin 54 Jahre und auch mir würden sofort Medikamente zur Therapie verordnet. Nach diversen Nebenwirkungen, wie Augen-, Speiseröhrenentzündung, Knochenschmerzen ….Neve ich nach gründlicher Untersuchung keines der Medikamente ein.
Zum Glück befürwortet auch mein Endokrinologe die Zusammenarbeit mit dem Heilpraktiker.
Vitamin D, K2,Magnesium…. und vorallem Sport stehen nun auf meinem Therapieplan.
Ich bin gespannt auf den kommenden Check.
DeinTipp mit dem Minitrampolin nehme ich noch mit auf.
Dankeschön, habe bereits darüber recherchiert.
Liebe Grüße
Hallo, Frau P.,
könnten Sie mir die Adresse des Osteoporosezentrums von München senden?
Ich soll auf Grund von Osteoporose mit Wirbelbrüchen eine Therapie mit Infusion und Hormonen erhalten. Ich wurde über keinerlei Alternativen aufgeklärt. Ich bin 56 und habe Zweifel, da es wenig bzw. Negativerfahrungen während der Therapie und vor allem nach Medikamentabsetzung gibt. Jeder empfiehlt andere Präparate, wem soll man vertrauen?
Danke im Voraus.
Hallo Birgit,
das tut mir sehr leid, dass Sie schon Wirbelbrüche hatten. Ich stehe der speziellen Osteoporosetherapie auch sehr kritisch gegenüber, daher kann ich Sie sehr gut verstehen. Ich hatte bisher keine Brüche, obwohl meine Werte teilweise sehr sehr schlecht sind.
Das Zentrum finden Sie unter: https://www.osteoporosezentrum.de
Ich war noch nicht dort, habe nur angerufen. Es kostet für Selbstzahler so um die 400 Euro. Als Zweitmeinung sicher gut. Hier gibt es auch ein gutes Video zum Thema mit Tipps: https://www.ndr.de/fernsehen/sendungen/die-bewegungsdocs/Gezielte-Belastungsuebungen-gegen-Osteoporose,bewegungsdocs330.html .Den dort erwähnten Vibrationsplatten jedoch stehe ich skeptisch gegenüber. Trampolinspringen (Stichwort Bellicon + Osteoporose) ist gut, eher ein Wippen als ein Springen. Ernährung optimieren, antientzündliche Ernährung (siehe z.B. Dr. Fleck von den Ernährungsdocs, Vitamin D, K2, Calcium, Magnesium (Calcium über Mineralwasser/Nahrung)). Grüße und viel…
Guten Tag,
für alle an Osteoporose interessierten Mitleser (m/w/d) möchte ich auf zwei sehr interessante Videos verweisen:
Die Sprechstunde zum Thema Osteoporose im Gespräch mit Prof. Dr. Dietmar Daichendt zum Thema neueste Erkenntnisse in der Osteoporose-Therapie (Dezember 2019):
https://www.muenchen.tv/mediathek/video/die-sprechstunde-osteoporose-medizin/
Osteoporose – Fehldiagnostik:
https://www.muenchen.tv/mediathek/video/die-sprechstunde-osteoporose-fehldiagnositik/
Viele Grüße
Sehr gute Videos! Seien Sie aber, liebe*r Patient*in, bitte nicht verunsichert, durch DXA evtl.eine „Fehldiagnose Osteoporose“ bekommen zu haben. DXA ist nach wie vor das Standardverfahren, das auch vom Dachverband Osteologie (DVO) empfohlen wird. Ergänzungen: 1.) Bei der Besprechung der DXA fehlte der TBS (Trabecular Bone Score), der Auskunft über die Spongiosa gibt. 2.) Es fehlte die präzise Warnung, bei Denusomab (Prolia) die sechsmonatigen Abstände zu überschreiten, damit nicht oft dramatische multiple Wirbelbrüche auftreten (siehe meine Berichte im DGE-Blog). 3.) Ob die Haltungsanalysen helfen können, gezielt einen Bruch eines bestimmten Wirbelkörpers zu verhindern, sei dahingestellt.
In diesem Video:
https://www.muenchen.tv/mediathek/video/die-sprechstunde-osteoporose-2/
wird u.a. etwas gezielter und differenzierter auf Medikamente eingegangen.
Dies ist doch das 1. Video von oben, in welchem eben NICHT vor Verschleppung der Folgeinjektion von Denusomab nach 6 Monaten gewarnt wird, sondern nur von „Entwarnung“ gesprochen wird, WENN EIN BISPHOSPHONAT angeschlossen wird. (N.b.: Die „Wirbelsäule“ besteht aus Wirbeln plus Bandscheiben. Der T-Score wird mit dem 30. Lebensjahr fesrgelegt, der Z-Score nimmt mit dem Alter ab).
Sehr geehrter Herr Professor Schatz,
es sind drei verschiedene Videos. Im allerersten Video, welches ich verlinkt habe, geht es primär um personalisierte Medizin, die typischen Osteoporosemedikamente werden so ab Minute 20 erläutert meine ich (habe nicht nochmals alles angeschaut). Im letzten Video, welches ich nachgetragen habe, wird detaillierter auf die Medikamente eingegangen, so ab Minute 13 . Aber Sie haben recht, es gibt keine präzisen Warnungen etc. Es ist ja primär ein Video für Patienten, die Warnungen müssten doch primär von den Ärzten gegenüber ihren jeweiligen Patienten ausgeprochen werden, meine ich, sicher möchte man die Patienten nicht zu sehr beunruhigen…
Hallo sehr geehrte Damen und Herren,
vor 1 Jahr wurde bei mir Osteoporose diagnostiziert. (Zufallsbefund)
Am Oberschenkelhals Wert 3,7 und an der Wirbelsäule Wert 3,1
Mir wurde sofort zu einer Therapie mit Bisphosphonaten geraten.
Dagegen habe ich große Bedenken!!!
Totzdem habe ich jetzt zum zweiten Mal mit der Einnahme von Risedronat begonnen.
(Angst vor Oberschenkelhalsbruch)
Und jedesmal musste ich abbrechen, wegen massiver Speiseröhrenentzündung mit Pilzbefall.
Beim zweiten Versuch sind diese Symptome bereits nach Einnahme der ersten Tablette aufgetreten.
Nun bin ich ziemlich ratlos. Am liebsten würde ich es genauso machen, wie Frau P. habe aber zu große Ängste.
Zu was würdet ihr mir raten?
Herzliche Grüße
Hanne
Können Sie meinen Namen bitte mit Hanne K. abkürzen?
Sehr geehrte Frau K., ich gehe davon aus dass Ihre Zahlen (3.1 und 3.7) den T-Score von -3.1 und -3,7 bedeuten. Wenn dem so ist und Sie keine Tabletten wie etwa Bisphodphonate vertragen, könnte man auch Zoledronat infundieren, z.B. alle 6 Monate. Das müssen Sie aber mit Ihrem Arzt besprechen .
Sehr geehrter Prof. Schatz,
Ich (65 J.) bekomme nun schon seit 6 Jahren die halbjährliche Prolia-Spritze. Nun höre ich von Problemen beim Absetzen. Kann Prolia einfach immer weiter gegeben werden?
Und käme eine Therapie mit dem neuen Romosozumab in Frage?
Ein akut erhöhtes Frakturrisiko habe ich (glaube ich) nicht.
Vor 30 Jahren wurde bei mir eine „High-Turn-Over-Osteoporose“ festgestellt, nach der Geburt meiner Tochter.
Liebe Frau Marlene D., wenn Sie schon auf Denusimab (Prilia) sind, so setzen Sie es streng halbjährlich fort. Langzeitresultate gibt es noch nicht. Lassen Sie alle (1-)2 Jahre die Knochendichte (DXA) kontrollieren. Wenn die Wirkung nachlässt oder gar nicht mehr da ist, kann man auf Alendronat, 1x wö. 70 mg, oder Zoledronat umsetzen (mit Ihrem Arzt besprechen!). Romosozumab (Evenity) ist osteoanabol, nach Denusomab gegeben sind mir keine Untersuchungen bekannt (wohl vor Denusonab).
Sehr geehrter Herr Professor Schatz,
vielen Dank für Ihre Antwort!
Das hat mir sehr geholfen.
Hallo, ich bin Ingrid..77jahre alt. Habe einen Mittelwert 36 bei der osteop.messung
Soll Actimel nehmen.Habe chronische magenschleimh.Entzündg.und manchmal auch Fremdkörpergefühl im Hals. Mein Mann nimmt Prolia und verträgt es. Ich habe Angst eine Nekrose zu bekommen. Habe sicher auch ein hohes Risiko dafür.
Oft habe pilzerkrankung.unter der Brust ,im Genitalbereich, trotz aller peinlichste
Hygiene. Hab Salbe bekommen. Außerdem habe ich Brennen im Mund..Zunge Gaumen. War zum Zahnziehen in Mund. Gesichts..Kiefer . Arzt. Der meinte das
Brennen im Mund könnte auch durch Pilz sein. Ich habe Angst ein biesphosphonat oder dinosubab zu nehmen….Kiefernekrose..??q
Lieber Herr Prof. Schatz,
mit welchem bildgebenden Verfahren werden Kiefernekrosen diagnostiziert? DVT?
MFG
Gordon
Das ist Thema der Zahnärzte und Kieferchirurgen. I.d R.erfolgt wohl eine Orthopantomographie (Panoramaschichtaufnahme), die neuere Technik der digitalen Volumentomographie (DVT) liefert sehr exakte Informationen.